杭州医学院许秋然团队在自适应调控酶递送增强肿瘤治疗中取得新突破
4月6日,杭州医学院许秋然研究员课题组联合华中科技大学刘波教授课题组在国际权威期刊《Advanced Science》(中科院一区TOP,IF=15.1)发表题为“Engineering Phage Nanocarriers Integrated with Bio-Intelligent Plasmids for Personalized and Tunable Enzyme Delivery to Enhance Chemodynamic Therapy”的研究论文。该研究将适应性强的T4噬菌体载体与生物智能质粒无缝整合,为肿瘤治疗提供了一种有前途的方法。许秋然研究员为论文的末位通讯作者,华中科技大学刘波教授为论文共同通讯作者,论文通讯单位为杭州医学院。
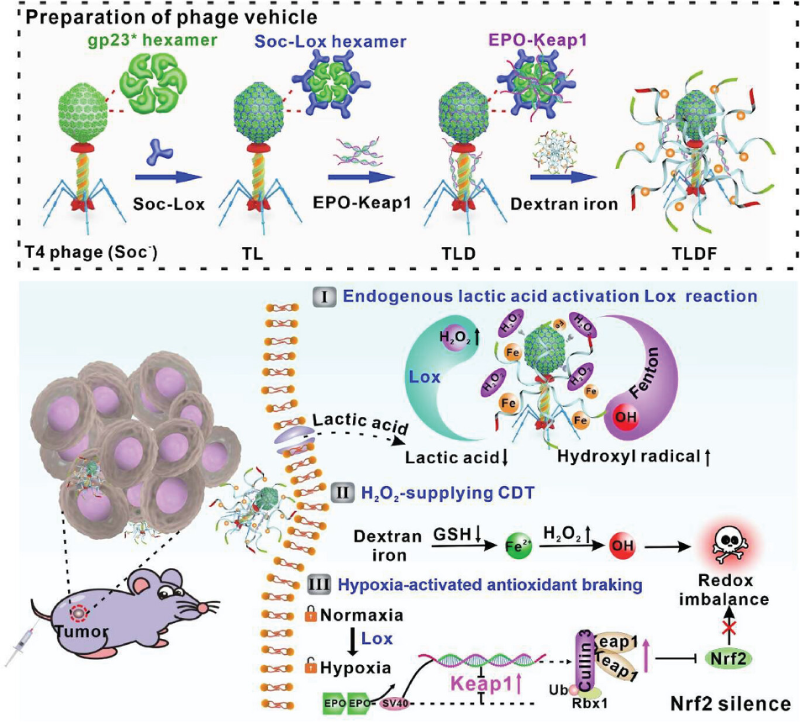
T4噬菌体具有强大的蛋白质结合能力,使其成为蛋白质运输的特殊载体。外源蛋白可以组装在T4衣壳上,并保持结构和功能的完整性。噬菌体展示技术是一种强大的工具,有助于在噬菌体表面显示外源性蛋白质。此外,融合蛋白组装的浓度调节噬菌体表面的蛋白质数量。这种可调功能使研究人员能够调整蛋白质丰度,以满足不同的实验要求和应用。酶精确地催化生物体内化学反应,将肿瘤微环境(Tumor Microenvironment,TME)中内源性底物转化为有毒物质,广泛应用于肿瘤化学动力学治疗(Chemodynamic therapy,CDT)。然而内源性H2O2含量有限,限制了CDT的有效性。作为一种关键的能量来源,乳酸在TME中含量丰富,浓度(5-20μmol/g)超过葡萄糖(1-2μmol/g),在肿瘤生长、转移和复发中起着关键作用。TME响应的纳米材料在肿瘤治疗的应用中也越来越广泛。例如,已经开发出对缺氧敏感的药物,如替拉帕嗪,能够精确靶向肿瘤细胞。这说明,缺氧激活的智能调节质粒通过破坏肿瘤氧化还原稳态,能够有效增强治疗效果。因此,通过消耗乳酸重塑TME并实现连续催化H2O2产生的策略将有助于大大提高CDT的有效性。
基于以上的科学假设,杭州医学院许秋然研究员课题组联合华中科技大学刘波教授课题组借助体外噬菌体展示技术,构建了用于增强CDT的T4-Lox-DNA-Fe(TLDF)蛋白载体。首先,定制的Soc-Lox融合酶被显示在T4噬菌体表面(T4-Lox,TL),可以调整融合蛋白和结合位点的摩尔比,以灵活调节蛋白质丰度。利用高浓度内源性乳酸作为“Key”,触发Lox酶促过程过程并通过级联反应,重塑肿瘤的能量代谢并产生H2O2增强CDT。然后,双串联EPO增强子掺入EPO-Keap1质粒中,使其具有缺氧活化能力。这使得缺氧TME充当另一个“Key”,激活生物智能EPO-Keap1质粒干扰Nrf2信号通路。这一新型TLDF生物智能纳米探针表现出“个性化肿瘤治疗”的特性。此双管齐下策略有效地破坏氧化还原稳态,引起线粒体功能障碍,增强治疗效果。并且,TLDF在分子、细胞和组织器官水平上表现出良好的生物相容性和低免疫原性。TLDF探针是第一个将噬菌体展示技术与自适应调控质粒(氧敏质粒)相结合的探针。该策略结合了合成生物学和纳米技术,为抗肿瘤治疗提供了新的思路。
文章来源:基础医学与法医学院
编辑校对:徐琦
审核: 许秋然