喜迎党的二十大---创新助力健康 (二)张衍梅
靶向精准诊疗 助力人民健康
张衍梅博士长期从事分子生物学领域的教学与科研工作,承担细胞生物学、病理生理学、分子医学等课程的教学任务。张博士带领团队开展了癌症和炎症靶标因子的功能研究及靶向药物的筛选和优化等多个方向的研究。搭建了恶性肿瘤的分子诊断平台。在疾病的靶标研究和靶向治疗领域做出了突出贡献。
张衍梅,检验医学院、生物工程学院副研究员,理学博士,硕士生导师,浙江省医坛新秀,毕业于武汉大学生命科学院遗传学专业,法国国家科学中心药理学与结构生物学研究所联合培养博士生,曾在美国弗吉尼亚大学健康中心任研究助理。主要研究方向为肿瘤的分子分型、疾病靶标因子的功能研究及靶向药物的筛选和优化,从蛋白质的翻译后修饰、circRNA和融合RNA的表达调控等方面解析疾病发生发展的机理。基础科研需要研究工作者长时期持之以恒的投入,最考验科研工作者的耐心和毅力,在研究的漫漫长路上失败和气馁是常有的事,成功和让人兴奋的结果却极其稀少。一个新药从发现到临床应用可能需要十年甚至更久,正是因为众多科学家的反复验证才能真正有益于人民健康。虽然研究结果总出乎意料,但只要坚定目标不忘初心,研究总会在不断的考问设计和修改方案的进程中向前。张衍梅博士先后获得过国家自然科学基金面上项目、青年项目、国家留学科技计划择优资助项目、浙江省自然科学基金等项目的资助。在Molecular Cancer和Cancer Discovery等杂志发表多项学术研究成果,任Signal Transduction and Targeted Therapy等杂志审稿人。
临床药物关乎患者的生命和健康,所以应尽可能的考虑药物的适用人群、毒副作用等因素,基础研究的数据直接影响到药物后期的应用。如果基础研究不到位,那么后期药物在临床的应用将极大影响使用者的健康。因此,基础科研工作者应负责前期科研结果的可靠性和重复性。经过十余年扎实的研究积累,张博士发现癌蛋白BORIS是良好的肿瘤早期诊断的分子靶标,BORIS在癌组织特异表达而相应正常组织不表达,确证了BORIS高表达导致肺癌和结直肠癌进展,引起非小细胞肺癌顺铂耐药和结直肠癌5氟尿嘧啶耐药。进一步的机制研究表明癌蛋白BORIS通过调控RNA融合、抑制癌细胞凋亡,促进癌症发生发展,导致癌细胞耐药。在确证癌蛋白BORIS的功能和作用机制的基础上,以BORIS为靶点,分别从小分子药物及多肽药物两方面,筛选获得了靶向BORIS的生物活性物质,获国家授权发明专利两项。其中苍术苷的处理导致BORIS信号通路阻断,结直肠癌细胞增殖被抑制。BORIS靶向肽明显抑制多种癌细胞包括肺癌、前列腺癌等体外培养的癌细胞增殖,减缓体内非小细胞肺癌发生发展。张衍梅博士的研究首次获得了靶向BORIS的多肽抑制剂,该抑制剂能有效抑制肿瘤进程,填补了长期无靶向BORIS的药物的空白,促进了BORIS作为肿瘤靶标向临床应用的推进。
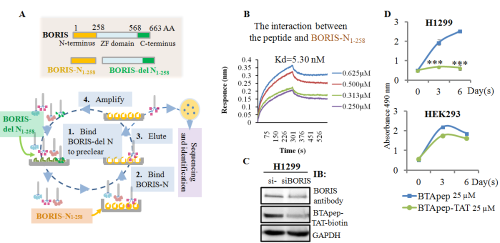
靶向BORIS的多肽抑制剂抑制非小细胞肺癌的发生发展
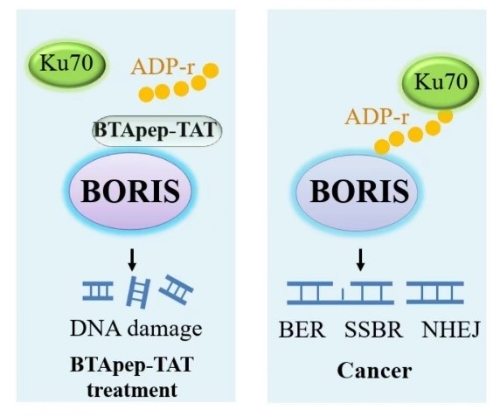
张衍梅课题组近期在国际TOP期刊《Molecular cancer》杂志(中科院1区,IF=41)上发表研究论文《BTApep-TAT peptide inhibits ADP-ribosylation of BORIS to induce DNA damage in cancer》。该研究揭示了癌症中普遍表达的癌蛋白BORIS的引导癌细胞发生异常DNA修复的分子机制,并首次报道了靶向抑制癌蛋白BORIS 功能的抑制肽BTApep-TAT。BTApep-TAT结合癌蛋白BORIS的N端氨基酸,诱导癌细胞凋亡和DNA损伤,并缓解非小细胞肺癌的发生发展。在此基础上课题组利用BTApep-TAT研究了BORIS对癌细胞DNA损伤修复的功能。研究发现BORIS促进癌细胞中的单链DNA损伤修复和双链DNA损伤修复,而BTApep-TAT对BORIS的抑制导致癌细胞DNA损伤。进一步的分子机制研究发现,BORIS蛋白198-228AA区段内的核糖基化修饰响应癌细胞中DNA的损伤,BORIS的核糖基化募集Ku70参与修复细胞内的DNA的损伤。BORIS蛋白198-228AA区段内谷氨酸上的核糖基化是修复癌细胞中DNA损伤的关键氨基酸。BTApep-TAT对BORIS 198-228AA区段内谷氨酸上核糖基化修饰的抑制是杀伤癌细胞的主要原因。
BORIS靶向肽抑制BORIS的核糖基化修饰诱导癌细胞DNA损伤的机制示意图
张衍梅博士等首次发现了BORIS蛋白上的调控癌细胞DNA损伤修复功能的翻译后修饰的类型和关键氨基酸位点,诠释了癌蛋白BORIS在癌细胞中的作用机制,首次筛选获得了靶向抑制BORIS功能的抑制肽,为临床上利用BORIS诊断癌症提供了依据,为靶向BORIS的癌症治疗提供了前体药物和评价方法。