杭州医学院黄东胜教授肿瘤精准医学研究领军创新团队取得多项科研新成果
肿瘤的精准诊疗在个性化医疗、药物治疗和预后监测等方面展现出巨大潜力。2021年我校根据《杭州医学院重点创新团队》(杭医【2020】62号)文件精神成立以杭州医学院黄东胜教授为负责人的肿瘤精准医学研究领军创新团队,团队结合国内外肿瘤领域发展趋势及自身发展优势,主要致力于肿瘤遗传与表观遗传学、肿瘤干细胞与肿瘤微环境、肿瘤个体化诊断与生物靶向治疗、新型抗肿瘤药物研发等四大方向的研究。
自肿瘤精准医学研究领军创新团队成立起,团队成员以杭州医学院(含杭州医学院附属人民医院)作为第一申报单位,已立项多个国家级、省级科研项目,其中,获得国家自然科学基金3项,浙江省科技厅重点研发项目1项,浙江省杰青项目1项,浙江省自然科学联合基金重点项目1项,浙江省卫健委省部共建重大项目2项,浙江省中医药重点研究项目2项。杭州医学院(含杭州医学院附属人民医院)的团队成员作为第一作者或通讯作者发表SCI论文63篇,总影响因子402.428,平均影响因子6.39,其中影响因子大于10分的9篇。黄东胜教授作为第一完成人,团队成员作为骨干的项目《肝胰恶性肿瘤精准诊疗创新技术的基础研究及临床推广应用》获得2021年浙江省科技进步二等奖。团队成员许秋然获得浙江省杰青人才称号,窦常伟获得浙江省万人计划青年拔尖人才称号,许秋然、金娟、牟晓洲获得浙江省医药卫生高层次创新人才称号。
以下是团队部分科研新进展:
1. 纳米平台用于肿瘤的免疫治疗及增强声动力学治疗
近年来细胞膜包裹纳米颗粒已被用作仿生治疗平台,具有广阔的应用前景。团队设计了一种多功能仿生杂化膜纳米探针,该纳米探针是在负载二氢卟酚(Ce6)的ZIF-8分子筛表面包覆一层由中性粒细胞膜(Nm)和红细胞膜(Rm)组成的杂化膜(HM),并辅以抗坏血酸棕榈酸酯(PA)。在以炎症部位的内皮细胞为靶点到达肿瘤后,Rm中的酶催化PA产生的过氧化氢在肿瘤部位产生氧气。一方面,产生的氧气可以对缺氧引起的免疫抑制的肿瘤微环境进行重新编程,从而阻止免疫逃逸。另一方面,它能在超声激发下与声敏剂Ce6反应生成声动力学所需的活性氧。仿生杂化膜纳米探针对原位结直肠癌的治疗具有显著的协同作用,为结肠炎相关肿瘤的诊断和治疗提供了新的思路。
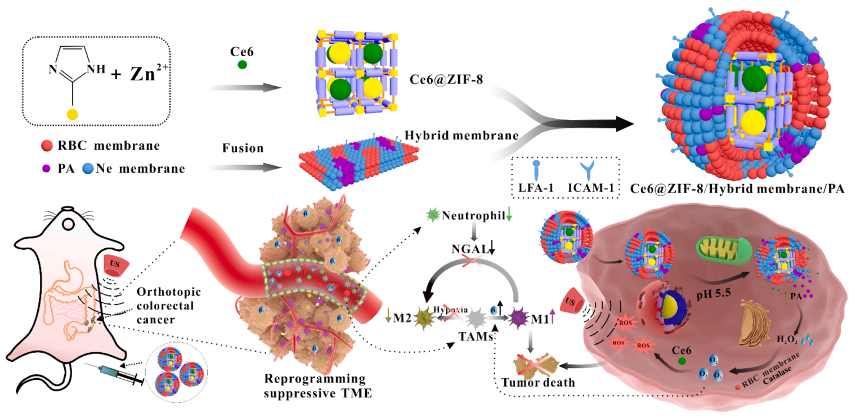
原位结直肠癌小鼠探针制备及诊治
上述研究成果以《Biomimetic O2 Self-generated hybrid membrane nanoplatform for blocking the polarization towards immunosuppressive M2 macrophage phenotype and enhancing sonodynamics therapy in orthotopic colorectal cancer》为题发表在Chemical Engineering Journal上(IF:16.74),杭州医学院的黄东胜教授为论文末位通讯作者。
论文链接:https://www.sciencedirect.com/science/article/abs/pii/S1385894722038207?via%3Dihub
2. 基于触发点击反应的响应性水凝胶合成及在肝癌治疗中的应用
水凝胶是一种含有大量水分子的三维网状结构,其网络中不同尺寸的孔洞允许了其它小分子物质在其中渗透和扩散,且自身具有良好的生物相容性以及生物可降解性,使其成为良好的载药平台。通过在交联纳米复合水凝胶的网络结构中加入硝基苄基等基团,通过点击反应提高体内药物释放效率,从而提高肝癌患者的存活率,延长肝癌患者的存活时间。纳米复合水凝胶给药系统的应用不仅可以长期丰富肿瘤部位的药物浓度,还可以有效防止残留肿瘤细胞的远处转移。团队根据以往工作基础和对相关领域的深入研究对纳米复合水凝胶载药体系进展进行了全面的总结。
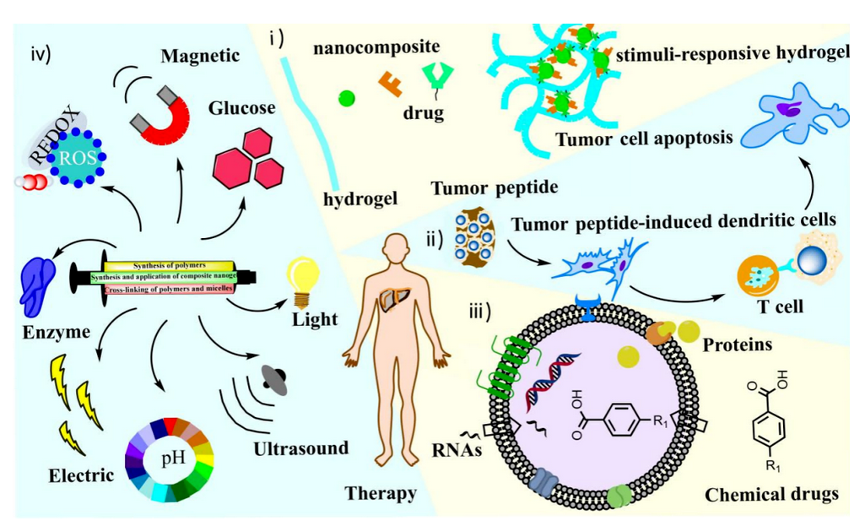
基于点击反应水凝胶的合成及其刺激响应调控药物的释放
团队从以下几个方面进行了概述:(1)设计合成用于治疗肝癌的反应性水凝胶的聚合物胶束,如:使用聚乙二醇水凝胶改善术中止血,使用海藻酸盐水凝胶可增强肝细胞功能,使用聚乳酸-羟基乙酸共聚物水凝胶有助于激活免疫反应,使用聚己内酯水凝胶利于聚焦放射治疗,使用透明质酸水凝胶增强药物靶向效果;(2)用于肝癌治疗响应纳米复合水凝胶的设计和组装,主要通过物理交联以及化学交联的方式合成水凝胶,再通过自组装、原位成型、渗透掺杂以及交联的方式合成纳米复合水凝胶;(3)基于刺激响应纳米复合水凝胶的响应性治疗,分别包括了内部环境刺激响应和外部刺激响应,如pH、氧化还原、酶、电、活性氧等内部刺激响应和热、光照、磁、机械、超声等外部刺激响应的载药体系。
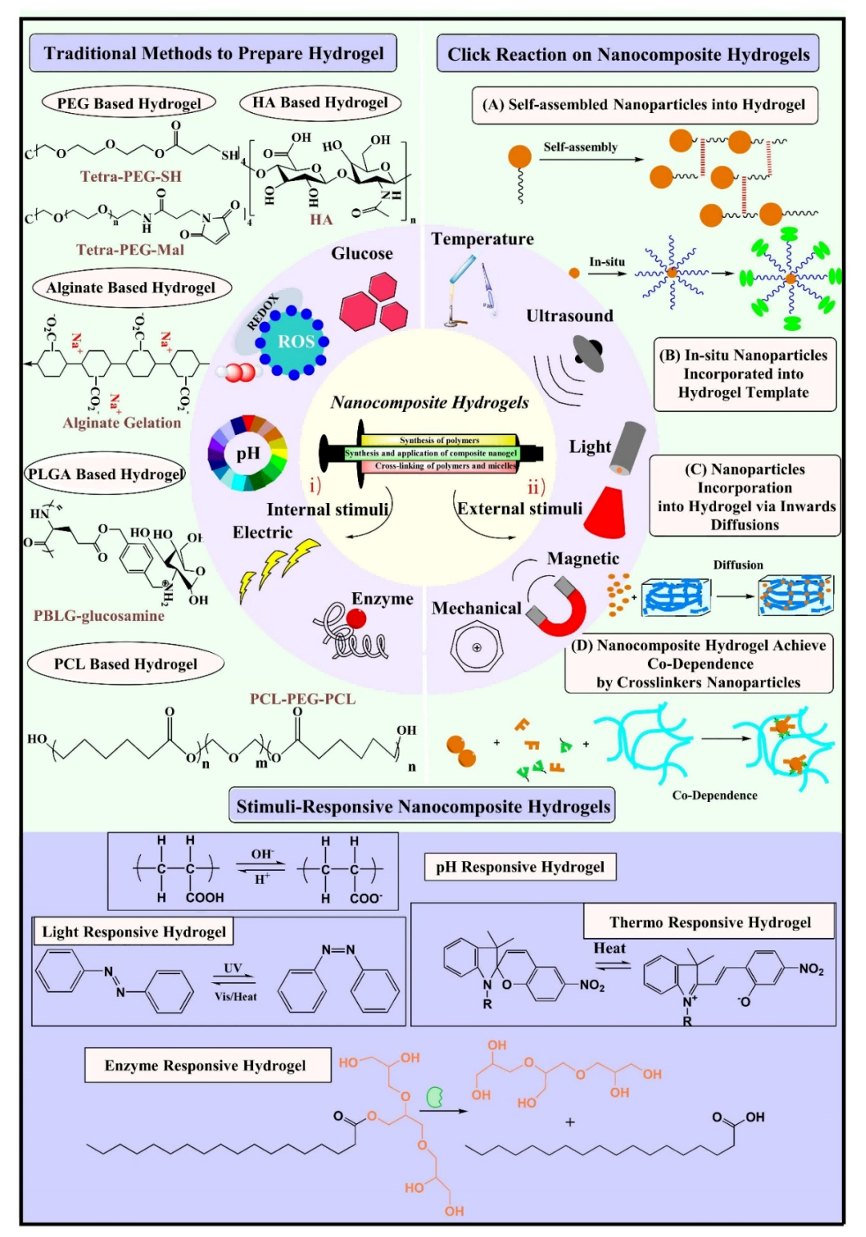
刺激响应调控纳米复合水凝胶的形成与应用
上述研究成果以《Responsive Hydrogel Based on Triggered Click Reaction for Liver Cancer》为题发表在Advanced Materials上(IF:32.08),杭州医学院的黄东胜教授和杭州医学院特聘教授杨田教授为论文共同通讯作者。
论文链接:https://onlinelibrary.wiley.com/doi/abs/10.1002/adma.202201651
3. 血小板膜包裹的仿生纳米粒增强肝癌免疫治疗
近年来在抗肿瘤研究领域出现了膜包裹纳米粒子,被认为具有良好的抗肿瘤药物载药特性。包裹在质膜中的纳米粒子像红细胞和血小板一样,减少了巨噬细胞其清除,减少了补体系统的激活。团队设计了一种在PLGA纳米粒表面包裹血小板膜来负载TIM-3抗体和PD-L1抗体的新型纳米治疗平台(BAT NPs)。一系列实验研究表明,BAT NPs携带的TIM-3抗体可以激活T细胞的增殖和迁移以及协同PD-L1检查点阻断发挥治疗作用。此外,血小板膜和TIM-3抗体可促进肿瘤微环境中微血栓的形成,从而通过胶原沉积辅助肿瘤饥饿治疗。这项研究创新性地研发血小板膜仿生纳米粒用于药物递送平台,将免疫调节治疗和乏氧治疗有机结合,构建全新的纳米免疫治疗体系,拓宽了血小板仿生纳米粒的疾病诊疗范围,丰富了PD-L1检查点阻断的内容。
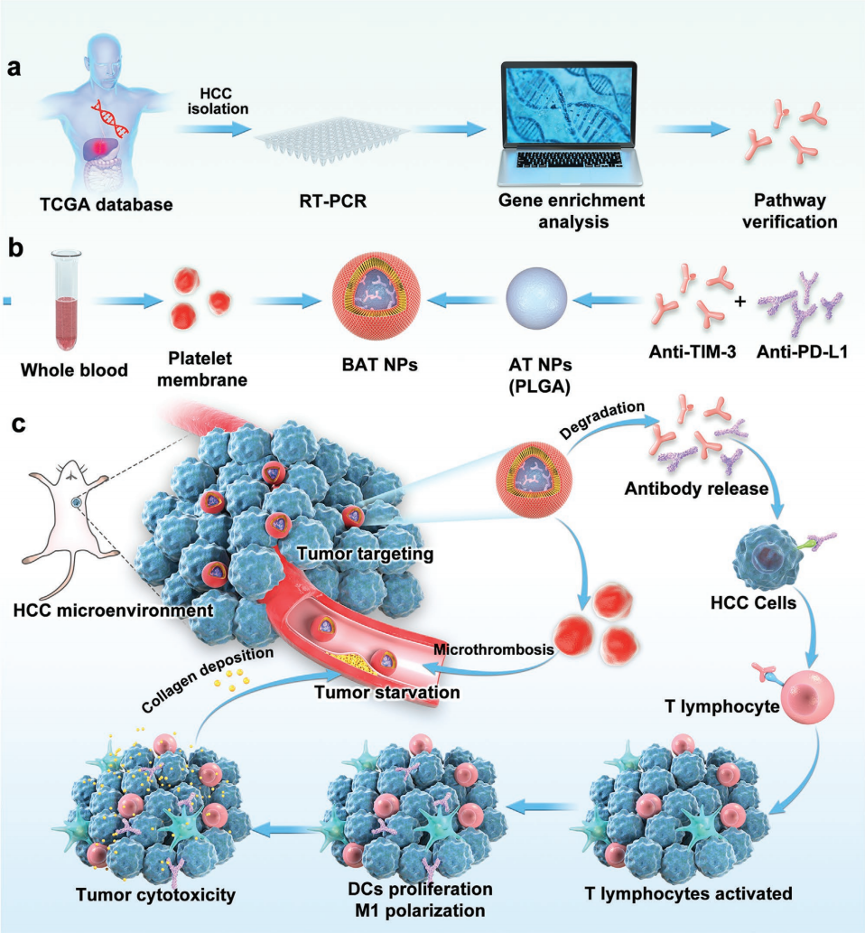
BAT NPs的生物信息学、合成、免疫检查点阻断治疗方案
上述研究成果以《Biointerfacing Antagonizing T-Cell Inhibitory Nanoparticles Potentiate Hepatocellular Carcinoma Checkpoint Blockade Therapy》为题发表在Small上(IF:15.15),杭州医学院的黄东胜教授和杭州医学院特聘教授杨田教授为论文共同通讯作者。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/smll.202105237
4.一体化纳米诊疗平台用于溃疡性结直肠炎的生物发光成像及协同抗炎治疗
溃疡性结直肠炎的诊断缺乏金标准,主要结合患者临床表现、内镜和病理组织学进行综合分析。髓过氧化物酶(MPO)催化醛类、次氯酸、羟基自由基等毒性物质的产生,促进炎症反应,造成组织氧化损伤。MPO 的表达量与 UC 的发生发展密切相关,因此,MPO 可作为 UC 的一种诊断指标。鲁米诺在 MPO 催化作用下产生蓝光,然而,鲁米诺的蓝光波长较短,限制其在活体深层组织成像中的应用。通过生物发光/荧光共振能量转移效应(BRET/FRET),将鲁米诺的蓝光转换为近红外光,有望实现对 UC 的高灵敏生物发光成像。
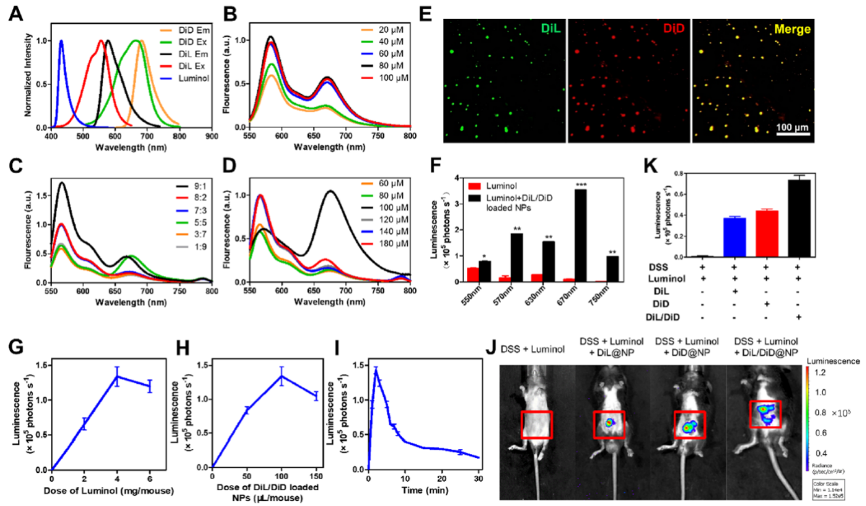
BRET-FRET效应可行性分析及对结肠炎症的高灵敏生物发光成像
白藜芦醇(Res)和白桦脂酸(BA)是两种天然化合物,研究表明,Res 可以抑制 IBD和炎症诱发的结肠癌; BA 能降低结肠中 MPO 和脂质过氧化水平,恢复结肠炎小鼠的过氧化氢酶和超氧化物歧化酶,降低谷胱甘肽水平,显著降低基质金属蛋白酶-9 和前列腺素 E2的表达。Res 与 BA 联合使用,有望实现更好的抗炎效果。
团队设计了一种两种亲脂性染料掺杂的(诊断)、Res和BA共递送的(协同治疗)一体化纳米诊疗平台(BA/Res@NP-PBP)。该一体化诊疗平台可将天然化合物BA和Res靶向递送到结肠炎症部位,在急性和慢性UC模型中发挥协同抗炎作用;基于BRET-FRET效应将鲁米诺产生的蓝光转换为近红外光,实现了对深部炎症组织的高灵敏生物发光成像。该一体化诊疗平台不但实现了UC的靶向治疗,而且为UC炎症的精准监测提供了可替代的方法。
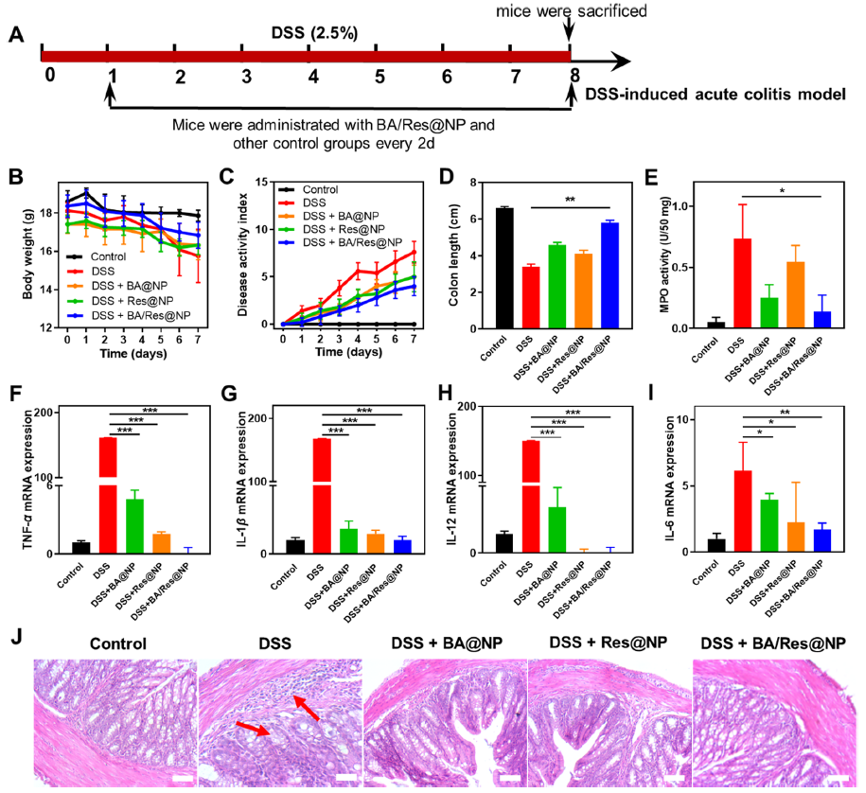
一体化纳米诊疗平台对急性结肠炎的治疗效果
上述研究成果以《All-in-one theranostic nano-platform based on polymer nanoparticles for BRET/FRET-initiated bioluminescence imaging and synergistically anti-inflammatory therapy for ulcerative colitis》为题发表在 Journal of Nanobiotechnology 上(IF:10.44),杭州医学院许秋然教授,杭州医学院特聘教授涂康生副研究员和张明真研究员为论文的共同通讯作者。
论文链接:https://link.springer.com/article/10.1186/s12951-022-01299-8
5.口服姜黄外泌体样纳米囊泡治疗溃疡性结直肠炎
植物外泌体样纳米囊泡富含生物活性脂质、蛋白质、RNA和其他药理活性分子,作为天然纳米载体具有独特的形态和组成特征,相较于动物来源的细胞基生物治疗剂或载体,植物外泌体样纳米囊泡具有来源广泛、价廉易得、功能丰富等优势。团队从姜黄(Curcuma longa)根茎中获取了姜黄外泌体样纳米囊泡(TDNPs 2),该纳米囊泡具有优异的抗炎、抗氧化性能。在口服条件下,TDNPs 2 能安全穿越上消化道并有效富集在结肠炎症部位,通过调控NF-κB信号通路,TDNPs 2显著缓解 DSS 诱导的溃疡性结肠炎及促进炎症的快速消退。植物外泌体样纳米囊泡生物相容性良好且可大批量分离提取,具有较好的临床应用前景。
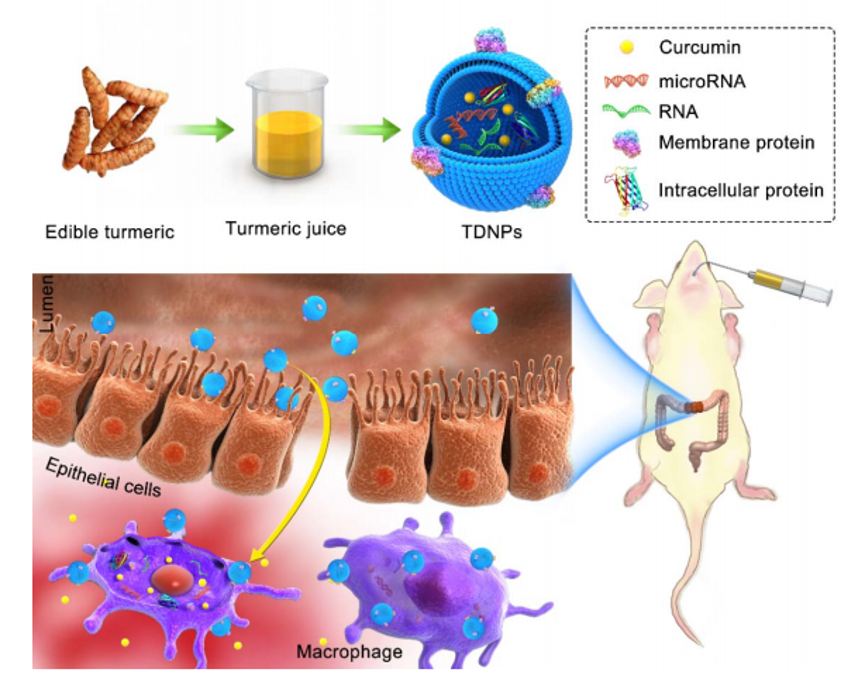
TDNPs 2治结肠炎症
上述研究成果以《Oral administration of turmeric-derived exosome-like nanovesicles with anti-inflammatory and pro-resolving bioactions for murine colitis therapy》为题发表在 Journal of Nanobiotechnology 上(IF:10.44),杭州医学院许秋然教授,杭州医学院特聘教授涂康生副研究员和张明真研究员为论文的共同通讯作者。
论文链接:https://jnanobiotechnology.biomedcentral.com/articles/10.1186/s12951-022-01421-w
来源 / 黄东胜团队 编辑 / 徐琦 初审 / 应士波 终审 / 许秋然