杭州医学院许秋然团队纳米酶肿瘤治疗领域取得新进展
近日,我校许秋然研究员团队联合华中科技大学赵元弟教授团队在材料领域国际著名学术期刊《Advanced Functional Materials》(中科院一区TOP,IF=19.92)发表题为“Tumor Microenvironment-Responsive Nanocarrier Based on VOx Nanozyme Amplify Oxidative Stress for Tumor Therapy”的研究论文。该研究设计了一种肿瘤微环境(TME)响应性的脂质体包被VOx纳米酶和小分子光敏剂氯蛋白E6(Ce6)(VC@Lipo),实现肿瘤的化学动力疗法(CDT)/光动力疗法(PDT)协同治疗。许秋然研究员为论文的末位通讯作者,华中科技大学赵元弟教授为论文共同通讯作者,论文通讯单位为杭州医学院。
来源:(https://onlinelibrary.wiley.com/doi/full/10.1002/adfm.202212740?saml_referrer)
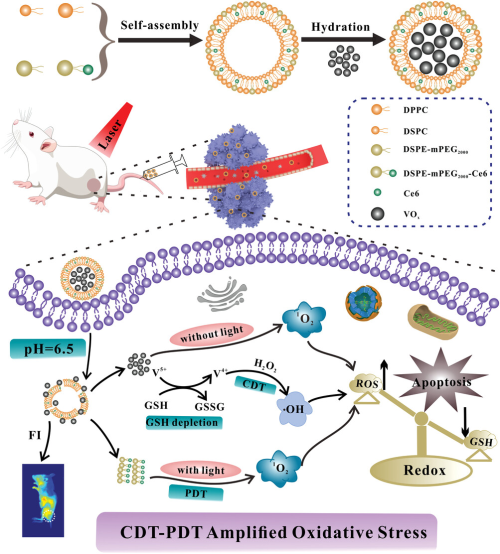
纳米酶是一种兼具纳米材料性质和天然酶催化活性的类酶纳米材料,具有催化活性高、成本低、稳定性强、催化活性易控等优点,已广泛应用于生物传感、免疫监测、抗菌、癌症治疗等生物医学领域。肿瘤微环境(TME)与癌症疗效密切相关。与正常组织相比,TME表现出一些独特的特征,如较低的pH值、较高的H2O2和谷胱甘肽(GSH)浓度。基于活性氧(ROS)产生和消耗的氧化还原稳态对细胞生存至关重要。GSH作为细胞中的主要抗氧化剂,在一定程度上维持细胞内氧化和抗氧化水平的平衡。过量的ROS(1O2,∙OH,O2−)将超出细胞的抗氧化能力,诱发氧化应激,导致细胞死亡。癌细胞通过增加内源性GSH来清除ROS,减轻氧化应激,维持生长和增殖。这大大减弱了基于ROS的化学动力疗法(CDT)、光动力疗法(PDT)和声动力疗法(SDT)的疗效。
来源:(https://onlinelibrary.wiley.com/doi/full/10.1002/adfm.202212740?saml_referrer)
通过构建新型纳米载体打破癌细胞的氧化还原平衡的是一种很有前途的新型抗肿瘤策略。在内源性刺激(酸、H2O2、缺氧等)下,基于纳米酶的TME响应性纳米平台能够通过其酶活性在肿瘤部位特异性增强氧化应激诱导的癌细胞凋亡。杭州医学院许秋然研究员课题组联合华中科技大学赵元弟教授课题组设计了一种基于VOx纳米酶的TME响应性VC@Lipo。在该设计中,首先使低水溶性的Ce6与DSPE-mPEG-NH共价连接,并与几种磷脂组分自组装,得到Ce6修饰脂质体(C@Lipo)。然后将混合价态的VOx纳米酶挤进脂质体亲水腔中构建VC@Lipo。作为一种新型TME响应性多功能纳米载体,VC@Lipo具有许多独特的优势:首先,在荧光成像引导下,VC@Lipo可通过渗透滞留效应(EPR)在肿瘤部位富集;其次,VOx纳米酶可以在TME的酸性环境中特异性释放,并被降解为+4和+5价钒化合物(V4+和V5+);然后,V4+通过类Fenton反应产生高毒性的∙OH,而V5+通过氧化还原反应消耗GSH,以增强CDT介导的肿瘤治疗。此外,VOx纳米酶可以在TME中不依赖光照产生大量1O2,这与光敏剂Ce6在光照下产生的1O2一起,大幅度上调ROS水平,放大氧化应激效应。体外和体内实验均表明,VC@Lipo具有良好的生物相容性和安全性,可以有效降低GSH含量并提高ROS水平,显著增强CDT和PDT的联合治疗效果,抑制肿瘤生长。经小鼠静脉注射6h后,VC@Lipo显著富集在肿瘤部位,经过激光照射后肿瘤抑制率达54.18%,显示出CDT联合PDT的最佳协同效果。本项研究为癌症的纳米催化治疗提供了一种新的范式,为癌症的精准治疗提供了新的思路。
供稿:基础医学与法医学院 审稿:应士波 终审:许秋然