AFM | 杭州医学院许秋然团队研发LDH基纳米酶双缺陷工程助力缺血性脑卒中治疗
近日,杭州医学院许秋然研究员课题组联合北京航空航天大学、中国科学院在国际权威期刊 《Advanced Functional Materials》(中科院TOP一区,影响因子IF=19.0)发表题为“Dual-Defect Engineering of LDH-Based Nanozymes to Enhance Antioxidative Effects in Ischemia Stroke-Reperfusion Injury”的研究型论文。该研究创新性提出双缺陷工程策略,通过调控层状双氢氧化物(LDH)纳米酶的电子结构与催化性能,高效清除缺血再灌注损伤中的活性氧(ROS)和活性氮(RNS),显著减轻脑损伤并改善神经功能,为氧化应激相关神经系统疾病治疗提供可转化的纳米治疗平台。
缺血性脑卒中再灌注损伤是临床治疗中的关键难题,其核心病理机制是氧化应激反应引发的ROS和RNS过量产生,进而导致线粒体损伤、脂质过氧化、神经炎症及神经元凋亡。纳米酶凭借类酶活性和高稳定性,成为该领域的潜在治疗工具,但传统纳米酶存在催化效率低、电子转移能力不足、RNS 清除能力有限等瓶颈,难以满足复杂病理微环境的治疗需求。如何通过精准结构设计提升纳米酶的ROS/RNS协同清除能力,是突破脑卒中治疗困境的关键。
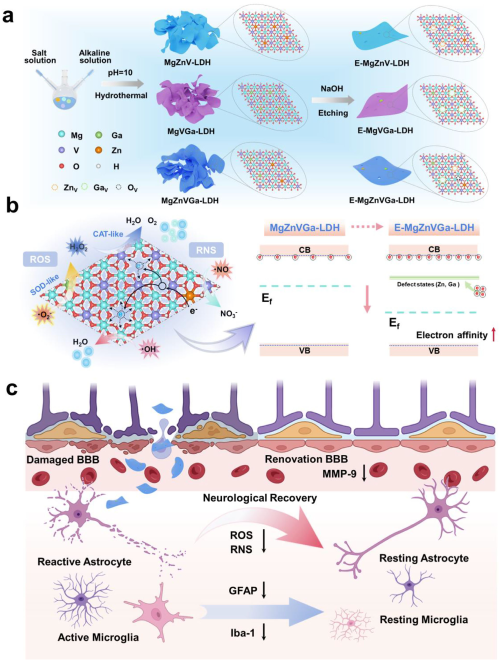
针对这一挑战,研究团队以LDH为基底,开发“双金属掺杂-碱性刻蚀”的双缺陷工程技术:以钒为催化中心,共掺杂锌(Zn)和镓(Ga)两种两性金属,利用离子半径匹配性实现晶格稳定嵌入;再通过氢氧化钠刻蚀策略,精准去除部分Zn²⁺和Ga³⁺,形成稳定的金属空位(Mᵥ)和氧空位(Oᵥ)复合缺陷结构,最终制备出E-MgZnVGa-LDH纳米酶。该双缺陷结构通过三重机制提升催化性能:优化钒原子的d带中心与费米能级,降低反应能垒;调节电荷分布增强电子转移效率;增加活性位点暴露并改善底物吸附能力,从而同步强化超氧化物歧化酶(SOD)样、过氧化氢酶(CAT)样活性及・OH、RNS 清除能力。
在体外实验中,E-MgZnVGa-LDH 展现出优异的生物相容性,能有效穿透血脑屏障模型,进入神经元后清除过量ROS/RNS,保护线粒体结构完整并恢复膜电位,显著降低氧化应激诱导的细胞凋亡。在小鼠大脑中动脉闭塞/再灌注(MCAO/R)模型中,该纳米酶可靶向富集于缺血损伤区域,使脑梗死体积减少 83.3%,并通过抑制星形胶质细胞和小胶质细胞活化,显著减轻神经炎症。行为学评估显示,治疗后小鼠的神经功能评分显著改善,运动能力在30天内持续恢复,疗效优于传统纳米酶及临床药物依达拉奉。转录组分析证实,E-MgZnVGa-LDH通过调控免疫反应、氧化还原代谢及神经元修复相关信号通路,实现抗炎、抗氧化与神经保护的协同作用。
该研究通过原子尺度的缺陷工程策略,建立纳米酶结构与催化性能的构效关系,突破传统纳米酶的性能局限:双缺陷协同机制为高活性抗氧化纳米酶设计提供新范式;LDH 基底的生物相容性与pH响应性,保障病灶靶向递送与临床转化潜力;简单绿色的合成工艺(水热合成+温和刻蚀)适合规模化生产。这种集高催化活性、靶向递送、多机制协同治疗于一体的纳米平台,不仅为缺血性脑卒中提供创新治疗方案,也为阿尔茨海默病、创伤性脑损伤等其他氧化应激相关疾病的治疗开辟新路径。
许秋然研究员为论文的末位通讯作者,论文通讯单位为杭州医学院,北京航空航天大学刘爱华和中国科学院范克龙教授为论文共同通讯作者。
图形摘要 a) E-MgZnVGa-LDH合成路线;b) ROS/ RNS清除模拟酶的酶学能力;c) E-MgZnVGa-LDH在缺血性脑卒中再灌注损伤中的治疗机制。
文献来源:https://advanced.onlinelibrary.wiley.com/doi/abs/10.1002/adfm.202517629
图文来源:许秋然课题组 审核:科研处