Jouranal of Nanobiotechnology | 杭州医学院药学院王俏团队发表关于西罗莫司纳米原位凝胶眼科制剂的制备及体内外研究的论文
2024年7月16日,杭州医学院王俏团队在期刊《Jouranal of Nanobiotechnology》杂志( 中科院一区TOP,IF=10.6)在线发表了题为“Preparation and in vivo and ex vivo studies of sirolimus nano-in-situ gel ophthalmic formulation”的研究性论文。
西罗莫司(Sirolimus,SR),也称为雷帕霉素(RAPA),是一种具有抗真菌和抗肿瘤特性的大环内酯类免疫抑制剂。它通过抑制哺乳动物雷帕霉素靶蛋白(mTOR)的激活,阻碍细胞周期从G1期到S期的进展,从而抑制T淋巴细胞的活化和增殖。此外,SR还通过抑制炎性细胞因子的释放发挥作用。最初被批准用于肾脏移植的免疫抑制,SR在2007年获得美国FDA批准用于治疗晚期肾癌。近年来,多项研究表明SR在治疗眼部疾病方面具有潜力,例如通过抑制mTOR、减弱HIF-1α-VEGF途径以及下调凋亡Caspase-3来预防青光眼神经变性。然而,SR的全身给药与多种不良反应相关,如肾毒性、神经毒性、高血糖和关节疼痛。此外,SR的极端疏水性和高分子量使其在配方开发中面临挑战。
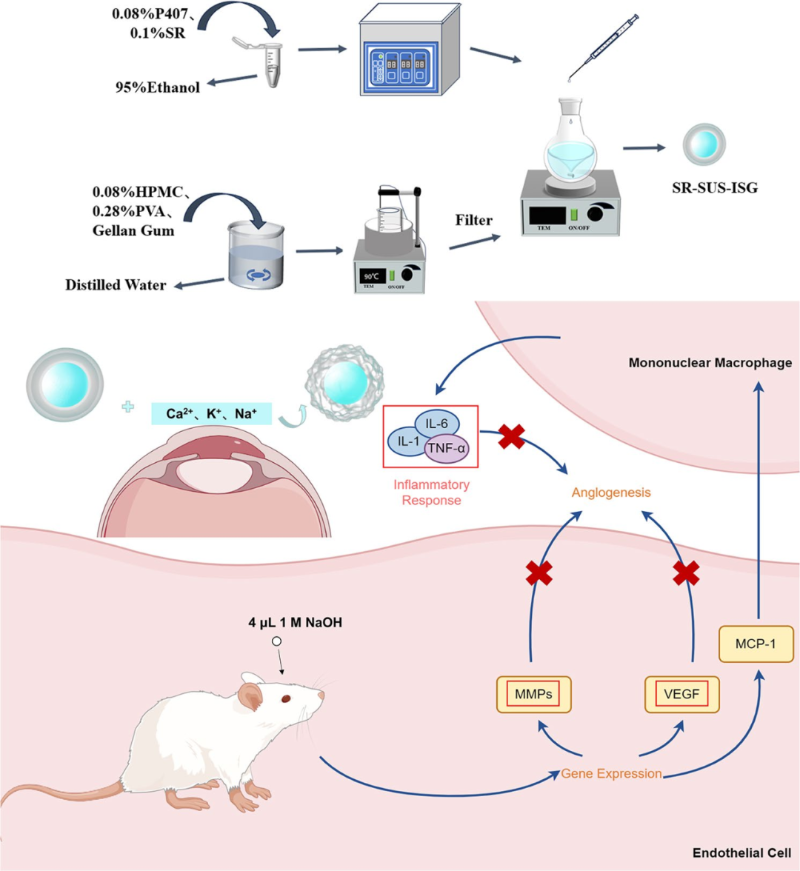
为了克服这些问题,来自杭州医学院药学院王俏团队研究者们探索了局部应用的眼科配方开发,以实现治疗眼部疾病的同时最小化全身不良反应。旨在开发一种基于结冷胶的离子原位凝胶西罗莫司纳米制剂(SR-SUS-ISG),以提高药物的溶解度、延长在眼表面的滞留时间,并增强药物的生物利用度。
图1. 示意图
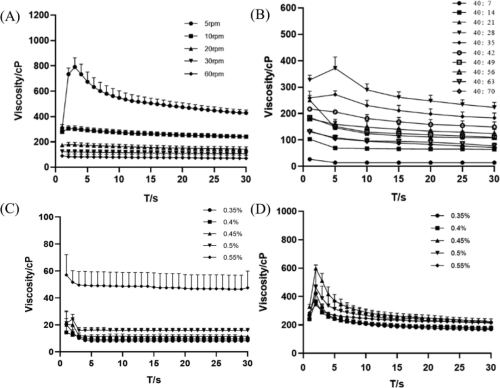
通过测定粘度进行处方筛选发现(图2),结冷胶浓度在0.3%到0.6%间最佳,过高或过低均影响其凝胶形成。在34℃和10 rpm条件下,结冷胶与人工泪液混合时会发生相变,粘度先增后减。因此,需先确定混合比例,再筛选结冷胶浓度。实验显示,结冷胶与人工泪液比例为40:28时粘度最大。此外,25℃时,0.55%结冷胶过于粘稠,而较低浓度流动性更好。但在34℃且与人工泪液以最佳比例混合时,0.45%结冷胶粘度最高,能在眼部表面停留更长时间。因此,最终确定最佳浓度为0.45%的结冷胶,它在室温下为液态、粘度低,34℃时则转变为凝胶状态,符合原位凝胶特性,利于灌装、运输和眼部应用。
图2. 制剂粘度的测定
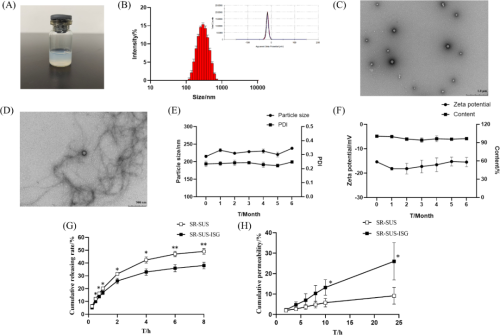
SR-SUS-ISG制剂呈均匀透明的乳白色,粒径为228.63 ± 1.59 nm,分布均匀,Zeta电位为-16.23 ± 0.80 mV,PDI为0.21 ± 0.01,显示良好的分散性,含量为99.34 ± 0.72%(图3A, B)。透射电子显微镜图像显示其呈球形,表面光滑,与人工泪液混合后出现结合物(图3C, D)。稳定性研究表明(图3E, F),SR-SUS-ISG在4℃下保存6个月后,粒径、PDI、Zeta电位和含量均保持稳定,粒径范围在220-240 nm,PDI在0.22-0.25,Zeta电位在-15至-20 mV,含量高于90%,表明SR-SUS-ISG在此条件下具有良好的稳定性。释放研究:本研究中,释放介质由1% SDS-PBS加入20%乙醇组成,先前研究表明加入助溶剂可增强BCS II类药物的体外释放。实验比较了SR-SUS和SR-SUS-ISG的释放结果,发现SR-SUS-ISG的累积释放率高于SR-SUS,6小时后差异显著(p < 0.05),之后差异高度显著(p < 0.01)(图3G)。使用透析袋和恒定药物量,结合结冷胶的存在,导致SR-SUS-ISG的药物释放率降低。两种制剂的释放均符合一级动力学过程,表明药物通过被动转运释放,且释放速率随时间逐渐减缓。根据Ritger-Peppas方程,SR-SUS和SR-SUS-ISG的n值均小于0.5,表明其释放机制为Fickian扩散,即药物的释放主要通过浓度梯度驱动的分子扩散过程进行。这一发现有助于理解SR-SUS-ISG的药物释放特性。
图3. SR-SUS-ISG的特性表征
R-SUS-ISG在24小时的累积渗透率显著高于SR-SUS(p < 0.05),其Papp和Jss均是SR-SUS的2.73倍(图3H)。这种差异可能归因于SR-SUS-ISG的粘度延长了在Franz扩散池弯曲开口处的停留时间,以及结冷胶的相变可能增强渗透。本研究选择巩膜渗透实验而非角膜实验,因为角膜活性可能限制渗透持续时间。实验发现孤立巩膜的累积释放率仅为体外释放的一半,可能是因为巩膜作为药物储存库,从结膜下/巩膜上间隙提供持续释放。与雷珠单抗脂质体的研究相比,体外透析膜释放接近100%,而孤立巩膜渗透仅为50%,进一步证实了巩膜作为药物储存库的作用
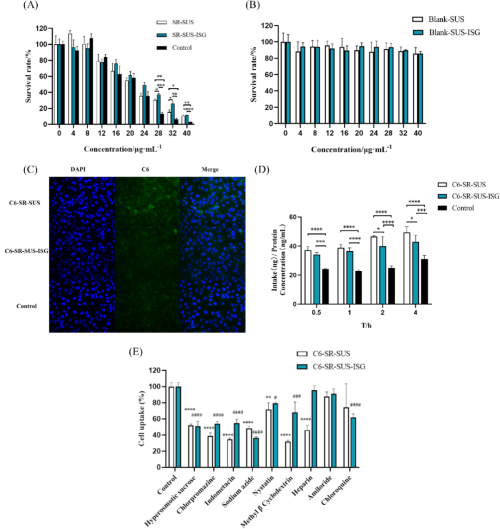
细胞增殖:如图4A所示,24小时后,HCECs对SR制剂的毒性结果表明,随着SR浓度的增加,细胞活性逐渐降低。两种SR制剂的细胞活性均高于SR溶液(对照组)。当SR浓度超过28 µg/mL时,SR-SUS-ISG的细胞活性显著高于SR-SUS和对照组,表明SR-SUS和SR-SUS-ISG对毒性有缓解作用。图4B展示了24小时后HCECs对SR空白制剂的毒性结果。两种SR空白制剂的HCEC活性均高于80%,表明空白制剂辅料具有良好的生物相容性。
细胞摄取:HCECs对C6-SR共载制剂的摄取具有时间依赖性,且C6-SR-SUS组的绿色荧光最强,显著高于C6-SR-SUS-ISG组和对照组(图4C)。随着时间的延长,HCECs对制剂的摄取逐渐增加(图4D)。在0.5、1、2和4小时时,HCECs对Cou6和SR共载制剂的摄取均高于对照组。然而,由于SR-SUS-ISG的物理状态和较大的粒径,其细胞摄取比SR-SUS更困难。在2小时和4小时时,C6-SR-SUS的摄取显著高于C6-SR-SUS-ISG。这表明,纳米颗粒的粒径是影响细胞摄取的重要因素之一。
摄取机制:HCECs对C6-SR-SUS和C6-SR-SUS-ISG的摄取涉及多种机制(图4E)。高渗蔗糖、氯丙嗪等物质显著抑制了C6-SR制剂的细胞摄取,美托洛尔和霉酚酸分别抑制了C6-SR-SUS和SR-SUS-ISG的摄取,与脂筏/囊泡样内吞作用有关。肝素显著抑制了C6-SR-SUS的摄取,与肝素硫酸蛋白多糖有关。氯喹通过破坏内体和溶酶体抑制了C6-SR-SUS-ISG的摄取。SR-SUS-ISG的摄取低于SR-SUS,除了粒径影响外,结冷胶可能阻断了肝素硫酸蛋白多糖的摄取,增加了内体和溶酶体的降解。
图4. SR-SUS和SR-SUS-ISG的细胞实验
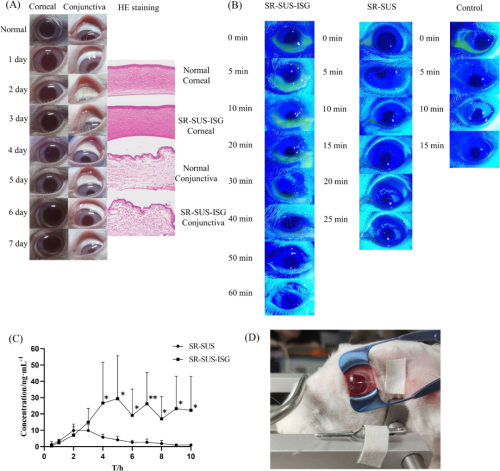
在体内安全性实验中,新西兰白兔接受SR-SUS-ISG滴眼液处理后,角膜、虹膜和结膜均未出现红肿或炎症等刺激症状(图5A),组织学分析也未发现明显的病理改变,表明该制剂具有良好的生物相容性。眼表滞留实验表明(图5B),SR-SUS-ISG在眼表面的滞留时间显著长于对照组和SR-SUS组,60分钟后仍可在眼睑观察到绿色荧光,表明结冷胶能够延缓药物的消失。
在药代动力学研究中(图5C,D),SR-SUS-ISG的房水浓度显著高于SR-SUS,其Cmax为33.42 ± 26.20 ng/mL,AUC(0-t)为174.88 ± 124.58 µg/L·h,分别是SR-SUS的2.81倍和3.54倍。这表明SR-SUS-ISG能够提供持续的药物释放,并维持治疗水平长达一天的剂量。
图5. 兔眼房水中的安全性、眼表停留时间及药代动力学研究
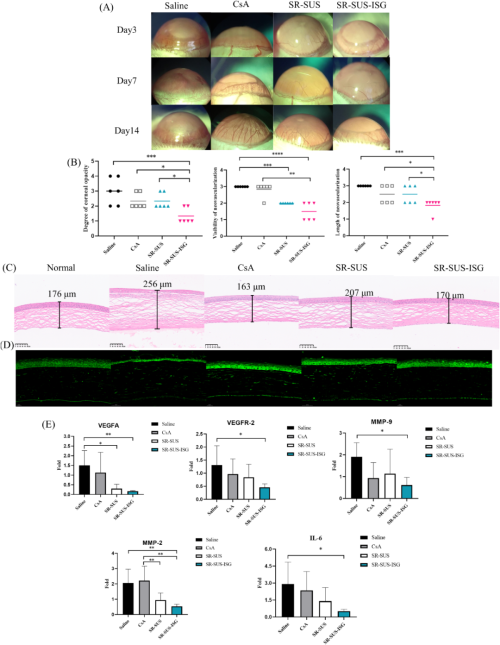
在大鼠角膜新生血管模型中(图6A,B),SR-SUS-ISG显著抑制了角膜新生血管的形成,其角膜新生血管长度和密度均显著低于其他组。H&E染色和免疫荧光组织化学分析显示(图6C, D),SR-SUS-ISG组的角膜结构更接近正常角膜,且VEGFA蛋白表达显著降低。此外,SR-SUS-ISG还显著抑制了VEGFA、VEGFR-2、MMP-2和MMP-9的基因表达,表明其通过调节血管生成相关因子来抑制角膜新生血管化。
图6. 药效学研究
本研究成功开发了一种基于结冷胶的SR离子型原位凝胶(SR-SUS-ISG),解决了SR溶解度低和眼部停留时间短的问题。与SR-SUS相比,SR-SUS-ISG在离体角膜穿透实验中表现出更高的渗透率和稳态通量。体内外实验结果表明,SR-SUS-ISG具有良好的生物相容性,能够延长药物在眼部的停留时间,并实现缓释和长效作用。此外,SR-SUS-ISG在大鼠角膜碱烧伤模型中显著抑制了角膜新生血管化,其作用机制与抑制VEGF和MMPs等关键基因的表达密切相关。综上所述,SR-SUS-ISG作为一种新型眼科制剂,在治疗角膜新生血管化方面具有潜在的应用价值,值得进一步研究和开发。
杭州医学院硕士生刘叶(目前已毕业),王俏研究员和汤湛副研究员为本论文共同通讯作者。杭州医学院为本论文第一和通讯作者单位。该工作受到国家自然科学基金项目和浙江省自然基金经费支持。
来源 :汤湛副研究员 审核:科研处