Adv Sci | 我校张逢质/叶增辉团队报道电化学驱动的镍催化不对称还原偶联反应:实现手性药物关键中间体的不对称合成
2024年9月12日,杭州医学院张逢质/叶增辉团队在国际权威期刊《Advanced Science》(中科院一区,IF=14.3)上在线发表了题为“Electrochemically Driven Nickel-Catalyzed Enantioselective Hydro-Arylation/Alkenylation of Enones”的研究论文。
手性𝛽-芳基酮是一种常见于天然产物、材料、药品或农药中的重要结构单元,其通常可以通过铑催化的迈克尔受体与芳基亲核试剂(如有机铜酸盐或硼试剂)的不对称共轭加成来制备。然而昂贵过渡金属及活泼芳基亲核试剂的使用极大地限制了此类反应的实际应用。因此,开发手性𝛽-芳基酮的安全实用、绿色高效地新型合成策略具有挑战性,并且有着重要的科学意义。
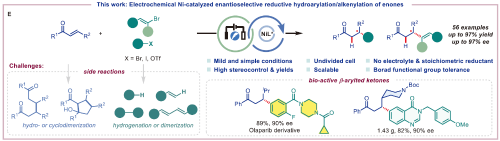
近年来,电化学有机合成利用电流作为可持续且本质安全的氧化还原试剂,只需通过改变电流或电压即可实现极端的氧化或还原能力,被认为是一种强大且可扩展的有机合成方法。本论文报道首个电化学驱动的镍催化不对称氢芳基化/烯基化反应。该技术利用廉价不锈钢电极,在无外加还原剂和电解质的简易电解池中,成功实现了烯酮与芳基/烯基卤化物的高选择性偶联,以高达97%的收率和97%的对映选择性(ee)合成了56种高价值β-芳基/烯基化手性酮类化合物(图1)。这一突破为手性药物合成提供了绿色、经济的新路径。
图1. 电化学驱动镍催化不对称氢芳基化/烯基化反应
一、技术原理与创新优势
传统镍催化不对称还原偶联依赖化学计量的金属还原剂(如锰粉),存在反应时间长、官能团耐受性差、成本高等缺陷。本团队通过电化学机制革新,实现了三大突破:1. 绿色反应体系;2. 高效催化循环;3. 卓越的对映选择性控制(图1)。
二、合成应用潜力
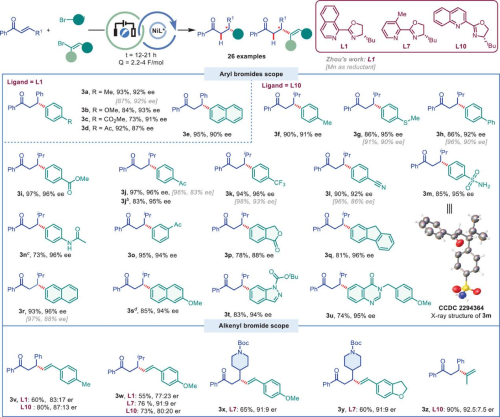
得益于电化学合成温和的反应条件,本论文所开发的方法具有极其广泛的底物兼容性,各种芳基卤代物、杂芳烃卤代物等均能耐受,并以极高的收率和优异的对映选择性得到目标手性产物。另外,各种芳基/烷基取代(环丙基、环己基、叔丁基等)烯酮结构均可适用。
图2. 广谱的底物兼容性
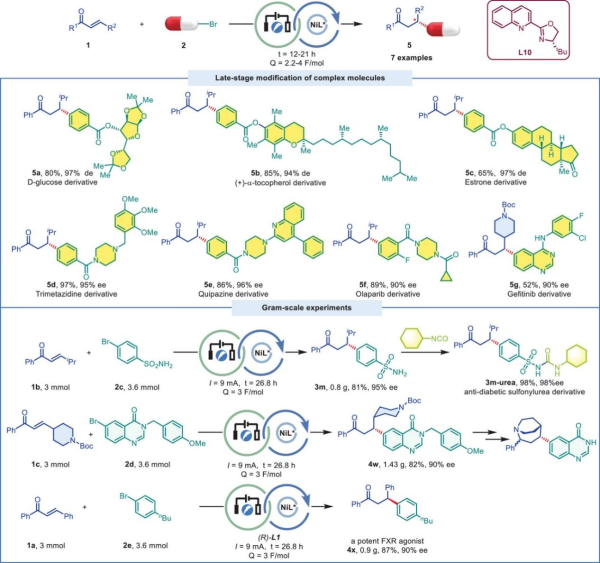
此外,本文成功实现了D-葡萄糖、生育酚、雌激素衍生物等天然产物及抗糖尿病药物磺酰脲类、抗癌药物(奥拉帕尼、吉非替尼)等药物的后期官能团化(图3)。
图3. 药物分子合成实例
杭州医学院叶增辉副研究员为本论文的第一作者,张逢质教授作为本论文的通讯作者。论文第一通讯单位为杭州医学院。相关工作得到了国家自然科学基金、浙江省自然科学基金和杭州医学院求真人才启动经费等的支持。
原文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202405926
来源:叶增辉 审核:科研处