Green Chem | 我校张逢质/叶增辉团队在对电解实现非天然氨基酸高效绿色制备领域取得新进展
2024年7月11日,杭州医学院张逢质/叶增辉团队在国际权威期刊《Green Chem》(中科院一区,IF=9.3)上在线发表了题为“Metal-free decarboxylative C(sp3)–C(sp3) bond formation for the synthesis of unnatural amino acids and peptides via convergent paired electrolysis enabled radical–radical cross-coupling”的研究论文。
非天然氨基酸(unnatural amino acids,UAAs)是一类不受遗传密码子约束的特殊氨基酸,由于其独特的功能基团和化学性质常被插入蛋白质中用来赋予蛋白质更高的活性和稳定性,其在有机合成和肽类药物发现中具有重要应用,但其合成仍然是有机化学家面临的重大挑战。C(sp3)-H烷基化是制备非天然氨基酸最直接、最受欢迎的构筑策略。目前,关于该策略的研究主要集中于过渡金属催化的反应。因此,开发绿色、原子经济且高效的新型合成方法,以制备具有重要价值的非天然氨基酸,具有重要的科学意义。
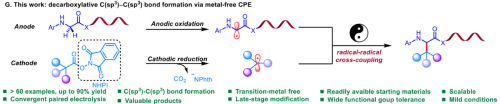
本论文报道首个无金属参与的脱羧C(sp³)-C(sp³)键偶联技术。该技术通过聚合成对电解策略,以甘氨酸衍生物和氧化还原活性酯(NHPI酯)为原料,在简易电解池中实现自由基-自由基交叉偶联,成功合成46类非天然氨基酸及多肽修饰产物(图1)。反应无需过渡金属催化剂,克级规模收率最高达86%。这项技术为非天然氨基酸多样性小分子化合物库的构建提供了新型且有效的制备途径。
图1、聚合成对电解合成非天然氨基酸及多肽
传统C(sp³)-C(sp³)键构建依赖贵金属催化或光化学手段,存在官能团耐受性差、底物局限等瓶颈。本团队所开发的方法基于聚合成对电解策略,分别使阴阳两极产生自由基(阳极生成甘氨酸衍生物自由基,阴极产生烷基自由基),通过缩短电极间距离,促使双自由基在电极间隙快速碰撞完成交叉偶联,生成非天然氨基酸及其类似物。本方法无需金属催化剂或额外氧化还原剂的参与,仅使用廉价易得的电子即可驱动反应发生,反应条件温和,具有潜在的工业应用价值。
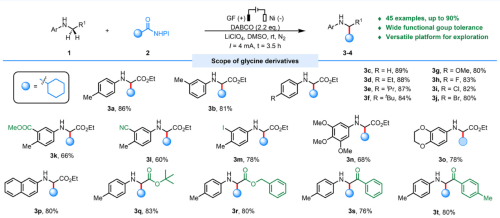
图2、广谱的底物兼容性
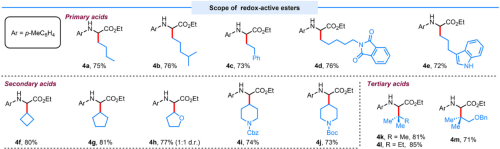
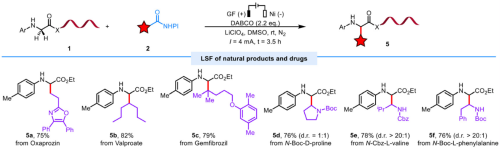
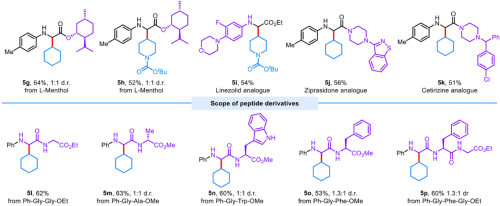
本论文所报道的方法不仅具有广泛的底物范围以及较好的官能图耐受性(图2),还可以用于复杂药物分子的后期修饰,以及多肽的后期修饰(图3)
图3、药物分子及多肽的修饰实例
杭州医学院叶增辉副研究员为本论文的第一作者,张逢质教授作为本论文的通讯作者。论文第一通讯单位为杭州医学院。相关工作得到了国家自然科学基金、浙江省自然科学基金和杭州医学院求真人才启动经费等的支持。
原文链接:https://pubs.rsc.org/en/Content/ArticleLanding/2024/GC/D4GC02848A
来源:叶增辉 审核:科研处